日付;2023/02/25(土)、2023/02/28(火)訂正、2024/03/31(日)有料化
一般的に、シングルセルRNAシークエンスの実験は、特に10xGenomicsのライブラリ調整キットを使用している場合、Chromium controllerを用いたエマルジョン作成に始まり、その後のライブラリ調整、最後にシークエンスを外注して、最終的に、Dual Indexを付けた場合はサンプルあたりI1、I2、R1、R2.fastqという4つのファイルがハードディスクなりダウンロードなりで納品される。その場合、cellranger mkfastqを用いる必要はない。しかし、他のラボのサンプルと、いわゆる”相乗り”せずシークエンスを行っているためBCLファイルを入手することが可能であり、かつ、その業者がシングルセルRNAシークエンスのfastqはどんなものなのか知らない場合、自分でこの4つのfastqファイルを作成する必要があるかもしれない。しかし、シークエンス業者の情報セキュリティー上、BCLファイルは貰えない場合が多いと予想されるので、cellranger mkfastqやbcl2fastq2はあまり必要でないとも言える。
そして自分は、まさかの一番最初のシングルセルRNAシークエンスで、なんというか、試練にしてはキツすぎるだろうが的な体験をしてしまう。詳しくは以前のポストを読んでくれれば良いが、某東大のおすすめであるiLacは利用したくないし、それと同じような、そして、更にキツい失敗”未遂”をしでかしたノボジーンも、利用したくない。お陰ですごく勉強になった。本当に感謝している。逃げなくてよかった。
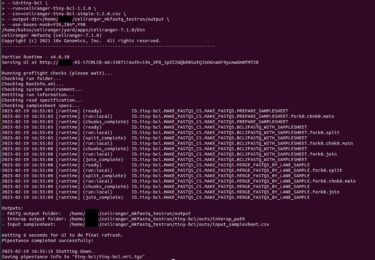
ということで、ここではcellranger mkfastqを使って、シークエンサーから出力されるBCLファイルをcellrangerで扱える型のfastqファイルを作成する方法の記録する。
もしcellrangerやbcl2fastq2のインストールが必要ならば、以前のポストを参考にすれば良い。長くなるし、結構面倒なのでここでは述べない。
詳しいこと10xGenomicsのホームページ(https://support.10xgenomics.com/single-cell-gene-expression/software/pipelines/latest/using/tutorial_fq)に書いてあるので、もし何か技術的なことで悩んだらこれをい読んだ方が良いと思う。
[outline]