日付;2021/08/20(金)
最近、RSSで論文誌に掲載される研究のタイトルやアブストラクトを拾っていて、度々すごく面白い研究に出くわす。それは放射線治療・放射線生物・放射線化学の分野での研究内容で、FLASHという放射線照射方法についての研究である。
FLASH
通常の放射線治療に利用されるX線の線量率はせいぜい数Gy/minというくらいなのだが、このFLASHという照射方法は、数十とか数百Gy/sという高線量率の放射線(X線・電子線・陽子線・炭素イオン線など)で放射線治療を行ってしまおう、というものである。ピカッと光るからFLASH。は??
これには驚くべき生物効果があるようだ。それはなんと、同じ線量を叩き込んでいるにも関わらず、腫瘍周辺の正常組織へのダメージがあまりなく、その一方で腫瘍自体には通常の放射線治療で用いられる線量率で照射した場合と同じような効果を与える、という、なんとも都合の良い効果である。
メカニズムとしては、現時点では自分はいまいち良く理解できていないので間違っている可能性もあるが、どうやら、「ものすごい線量率を叩き込まれた場合、もともと酸素分圧の高い正常組織内では急激に酸素が消費されて低酸素状態になることからこれが防護効果を発揮し正常組織へのダメージが減少するが、もともと低酸素状態の腫瘍には従来用いられてきてた線量率と同等の影響を与える」とか「FLASHにより生じる高密度なラジカル同士が相互作用してしまい、DNAと相互作用できるラジカルが減る」いうことが文献(1)に書かれている。この文献(1)、特に前者の文章は、もはや何言ってるのかわからない。おそらく著者ら自身も何書いてるかわからないんじゃあないだろうか。ちょっと調べてみると、どうやら「ものすごい線量率を叩き込むと、その飛程の近傍に存在する酸素が、その照射により生じた多くのラジカル類との反応のために消費されてしまい、元来、DNA損傷を固定しうる酸素ラジカルの生成が結果として抑えられてしまうから、もともと酸素分圧の高い正常組織での生存率が上がり、もともと酸素分圧が低い腫瘍組織ではそんなもの関係なく従来通りにDNA損傷が起こる。」ということらしい。文献(1)の著者はちゃんと勉強して、理解してから総説を書いてほしい。Googleのほうがわかりやすいのだが、これはどういうことなんだろうか。
しかし本当かいな??どうもウソっぽい。ということで、時間があるときにこのFLASHに関わる研究「っぽい」、クソったれた、怪しい、もっと言えば、眉唾な研究論文を読んで、片っ端から酷評してやろうと思っている。ちょっとみただけで言えるのが、ほとんどの論文で線量測定が良くない気がする。つまり、実際に生物試料に当たっている線量と、著者らが照射したと思っている線量が違っているので、実際はさっぱり線量が当たっていない生物試料について解析している可能性が高いと思っている。もしこの時点で反論する者がいれば、そいつに「じゃあ、実際に当たっている線量を示してみろ。なぜ示せない???」と言ってやる。まぁ、面倒くさいのでコメントは消すとしよう。
怪しいと感じる理由
すごく主観的で怒られそうだが、3つある。
理由1
線量測定が正しいとは思えないものが多い。
理由2
結果の都合が良すぎる。
理由3
過去に行われた怪しい(個人的はそう思える研究が多い)研究と同じ匂いを感じる。これは少し説明する必要がある。バイスタンダー効果である。放射線生物学におけるバイスタンダー効果とは、「照射を受けた近傍に存在している、実際には照射を受けていない細胞における放射線生物学的影響のこと」である。なんか色々な効果があるが、最もメジャーなものは、非照射細胞にも照射細胞と同じようなDNA損傷反応が起こったり、DNAの変異が起こったりする現象のことである。この研究の難点はいくつかあるが、一番の難点は、その実験系の難しさである。まず「非照射細胞」というのを厳密に実測することはほぼ不可能であると考える。シミュレーションを使った研究や単一細胞を照射できるマイクロビームを使った研究もあるが、生物学ならば、本当に、マジで照射されていないこと、もっと言えば、放射線に由来するラジカルなどの影響が全く及んでいないことを証明しないといけない。自分の博士課程の論文も、このバイスタンダー効果に触れている。しかしここで全力で考えてみて解ったことがこの体たらくだ。次に、その生物現象のレアさも問題である。「非照射細胞」を再現するために、照射室から放れた別の部屋で培養するなどして全く射線に曝されていない細胞を混ぜることでその状況を再現する方法もあるが、個人的には、そういった細胞に生じたダメージは本当に、いわゆるバイスタンダー効果を受けた細胞なのか、ただの統計的なノイズのような、偶然入ってしまったダメージなのか判断がつかない。良いコントロールがないとも言える。また、正しい統計解析をするのに、一体どれだけの細胞数をカウントしなくてはならないのだろうか。カウントしたところで、果たしてそんなめちゃくちゃレアなイベントは、本当に生物学的に有意(統計的にではなく)なんだろうか。そういう問題をすっ飛ばして研究してしまっているのが、このバイスタンダー効果の研究だったと思う。自分はこのFLASHというヤツにこのバイスタンダー効果とそこはかとなく同じ雰囲気を感じている。線量測定が上手く言ってないところとか、本当にそっくりではないか。
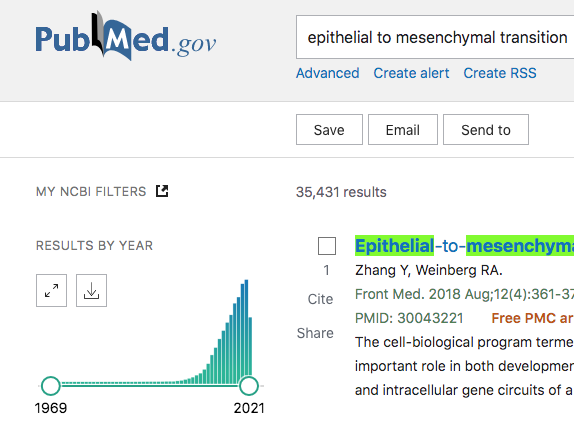
ちょっと視点を変えて、この「バイスタンダー効果」というヤツの研究のアクティビティーについてPubmedを使って簡単に見てみよう。それが下の図である。
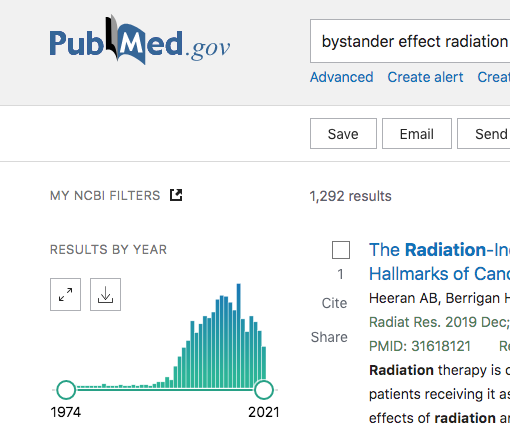
出版された論文数が激下がりである。つまり、今日では興味がないということである。なぜ一端の生物現象なのに「興味がない」なんてことが起こる??生物現象ならば何処かで何かに影響を及ぼすはずで、さらに、その影響がこれらの研究が言っているように統計的に有意ならば尚更ではないか。それが見られず(本当に見られないのかは知らないが)、興味も失われてきている。ということは、一体どういうことだ?専門家はなぜこれを継続的に解明しない?学会や研究助成金を提供している団体などのコミュニティーからも見放されてきているのか???おそらくこれがFLASHの研究でも起こるだろうと考えている。以下のFLASHの論文数については以下である。
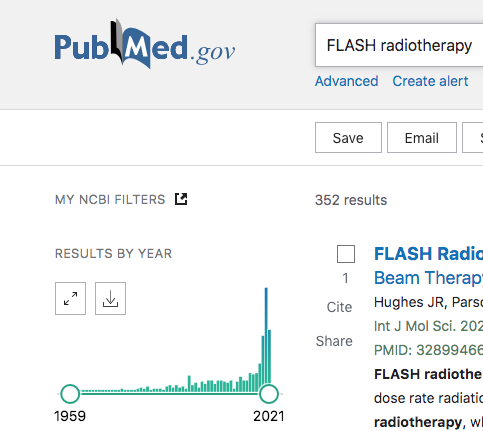
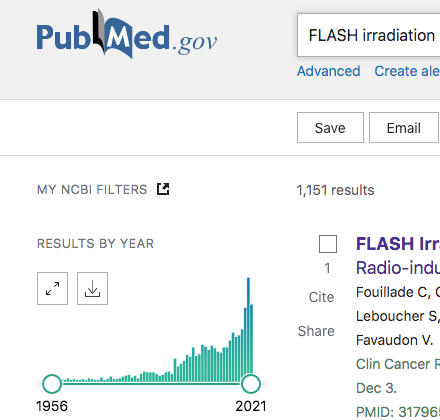
今は論文数が激増しているところらしい。そして、この激増期だからこそ、今手に入る論文を読んで、ボロクソにこき下ろし、もしくは、正当に評価することで、今後どうなっていくのかを予想してみたいと思う。
現時点の予想は「あと10年すれば研究していた当事者の誰もが隠したい歴史になる」と思う。
脱線するが…
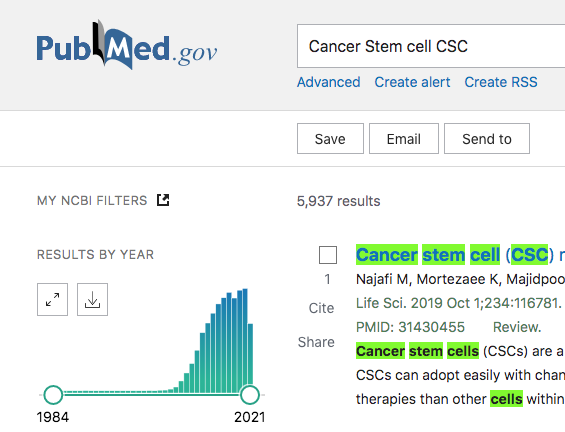
ついでにある種の陽性コントロールとしてがん幹細胞(CSC; Cancer Stem Cell)と上皮間葉転換(EMT; Epithelial to Mesenchymal Transition)についても示しておきたいと思う。興味深いのががん幹細胞である。なんと頭打ちになっており、今年から激減に転じてもおかしくない状態じゃあないか。しかし、これは何となく理由がわかる。すごく魅力のある研究テーマだが、要は検出が難しい。はっきり言って、一定の分子マーカーが現時点では無いし(CD44highCD24lowとか言ってるヤツ、駄目である。ちゃんと勉強してほしい)、GSEAのMsigDBでCancer Stem Cellのsignatureが無いが良い例(今はあるかも….)で、とらえどころがない感じがする。もっと言えば「がん幹細胞」なんて実質的に存在しないのではないか、という様に理解できないこともない。結局のところ「アグレッシブな性質のがん細胞」という括りから出れていないのが原因だろう。みんなこれに気づいてきて、研究テーマとしても、だんだん怪しい感じになってきているのかも知れない。個人的な意見としてこのがん幹細胞というヤツは、腫瘍毎(すなわち患者ごと)にエラい違う形相を見せており、当然、一定のマーカーなんか定めることなんかできない。ここが難しいところだと思う。しかし、確かにアグレッシブな性質な腫瘍はあるので、無視もできない、といったところだ。最近流行りのSingle cell multi omicsの研究が有効だろうと思う。しかし、これは眉唾だとは思わない。なぜなら、ちゃんと実験している(ノックダウンしたり、レスキューしたり)からだ。ここがFLASHなんかとは違う点である。EMTなんか凄い。この概念が出されてから随分経つのに、アクティブになる一方だ。逆に、乱立している感じはするが。
Reference
1.岩田 宏満, 芝本 雄太, FLASH Radiotherapy, RADIOISOTOPES, 2021, 70 巻, 4 号, p. 279-289,
